Обмен веществ и питание в горах (продолжение)
Жировой обмен
В литературе имеется немало указаний на то, что у участников высокогорных экспедиций и альпинистов на больших высотах уменьшается содержание жира в организме и ухудшается аппетит прежде всего к жирной пище (Ван Лир Э., Стикней К., 1967). Кроме того, имеются сведения о проявлениях нарушения жирового обмена на высоте (Владимиров Г. Е. и др., 1939, 1940, 1948; Байченко М. Н. и др., 1939).
Так, на высоте 4259 м отмечено увеличение в крови соотношения ацетон — ß-оксимасляная кислота (Владимиров Г. Е., 1948). В опытах при понижении давления в барокамере было обнаружено повышение выделения кетоновых тел с мочой, а также повышение концентрации общего ацетона и ß-оксимасляной кислоты в крови.
Эти сведения послужили поводом для высказывания мнения о том, что основной причиной вышеуказанных сдвигов жирового обмена в условиях высокогорья является кислородное голодание.
Эти и другие данные о нарушениях жирового обмена, а также сведения о предпочтительном сгорании углеводов на высоте, по-видимому, легли в основу определенных рекомендаций по питанию в условиях высокогорья. В частности, исследователи рекомендуют значительно ограничивать в высокогорном рационе жир.
Нельзя согласиться с категоричностью такого рода утверждений. По-видимому, нельзя преувеличивать значения указанных выше фактов и грубо нарушать принципы рационального питания. Тем более, что в литературе имеются сведения противоположного характера.
Так, имеются данные о том, что содержание липидов в плазме крови не изменяется на высотах, хотя и происходят определенные изменения в их спектре (Latti G., 1957). У людей, адаптированных к высоте 3300 — 4240 м, в крови не выявлено заметных изменений содержания жирных кислот, холестерина, фосфолипидов (Müller U., Talbott F., 1931). По мере акклиматизации выведение ацетона с мочой снижается. При акклиматизации, достигнутой в течение нескольких дней, на высотах может поступать в организм с пищей большое количество жира без существенных нарушений в его обмене. В результате даже на высоте 2300 — 5500 м не происходит заметного ухудшения всасывания жира (Molachlan P. L., 1946), хотя в целом пища усваивается хуже, чем в условиях низкогорья (Chinn К. S., Harmon J. P., 1969). Так, у молодых мужчин на высоте 3500 — 4700 м при содержании в рационе 3725 — 3900 ккал (углеводов — 650 г, белков — 120 г, жиров — 128 г) утилизация жира составила 95,6 — 96,6%. Увеличение доли жира до 364 г не ухудшило его перевариваемости (на уровне 4700 м она составила 97,5%), не увеличивалось и выведение кетоновых тел с мочой. Функции кишечника не нарушались, но по ночам отмечалась жажда (Rai R. M. et al., 1975). То же самое наблюдалось и в условиях экспедиции на Эверест: диета с 40% жира переносилась хорошо. Наоборот, обычный армейский паек с добавкой 340 г молока, 240 г фруктовых консервов, 200 г томатного и апельсинового соков, орехов, содержавший 3263 ккал (167,4 г белков, 103,4 г жира, 431,0 г углеводов), члены экспедиции переносили хуже, чем рацион, содержавший 3700 ккал (93,2 г белка, 138,0 г жира и 422,9 г углеводов) (Consolazio С. F. et al., 1968).
S. V. Rao (1968) установил, что у поднявшихся на высоту 4000 м солдат дополнительно полученные 200 г сливочного масла не вызывали расстройства пищеварения, ухудшения самочувствия или нарушения жирового обмена. Исследователи не обнаружили сколько-нибудь заметного отставания доли жиров в дневном рационе постоянных жителей высокогорья (Эсенаманова М. К., 1980).
Кроме того, данные литературы свидетельствуют о необходимости более дифференцированного подхода к вопросу об изменении жирового обмена на разной высоте, к учету не только кислородной обеспеченности, но и других факторов высокогорья. В связи с этим уместно подробно проанализировать прежде всего работу Г. Е. Владимирова с соавторами (1939).
Так, ими установлено, что в условиях основного обмена, т. е. при покое, в высокогорье окисление жиров даже усилено по сравнению с метаболизмами белков и углеводов. Г. Е. Владимировым с соавторами позднее (1948) были предложены специальные методы исследования для выяснения воздействия жирового компонента пищи в условиях высокогорья. Опыты проведены на Эльбрусе, на высотах 4250 м (Приют Девяти) и 5315 м (Седловина). Контролем служили опыты в Ленинграде и на склоне Эльбруса в Терсколе (2300 м). У испытуемых в крови и моче определялось снижение содержания ацетона и ß-оксимасляной кислоты, а в плазме — общего жира. Эти показатели определялись натощак, затем через 6 и 12 час после приема сливочного масла (по 2 — 3 г на 1 кг веса). В качестве «приправы» разрешалось съесть с маслом 10 — 15 г хлеба. Опыты с жировыми нагрузками проводились через день после подъема на высоту, т. е. акклиматизация ограничивалась только одними сутками. Результаты этих исследований убедительно показывают, что на указанных высотах в содержании ацетона, ß-оксимасляной кислоты в крови и моче, а также общего жира в плазме крови отличия от контроля фактически не было и использование организмом этого обычного количества жира происходило вполне нормально. В то же время дальнейший подъем выше 5300 м даже без жировой нагрузки зачастую приводил к увеличению кетоновых тел без параллельного повышения уровня общего жира в плазме крови. По мере акклиматизации выведение ацетона с мочой резко сокращалось. На основании этих исследований авторы пришли к заключению, что при акклиматизации, достигнутой в течение нескольких дней, на высотах могут вводиться с пищей даже большие количества жиров без существенных нарушений в ходе обмена жиров.
Работы ряда других исследователей также указывают на то, что нет убедительных доводов против включения жира в рацион питания в условиях высокогорья (Островская Л. П., 1949; Eguchi К. et al., 1974).
Однако, как было указано выше, имеющиеся сведения о жировом обмене в условиях высокогорья либо противоречивы, либо методические подходы к выяснению этого вопроса очень отличаются друг от друга.
В частности, данные, полученные на разных видах животных, по вполне понятной причине резко отличаются по характеру изменений, так как у них различна способность использовать жиры.
Е. S. Sundstroem, .W. R. Bloor (1920) установили, что кратковременное пребывание кроликов в барокамере с давлением, соответствующим высоте 6100 м, приводит к умеренному понижению липоидного фосфора в плазме. На «высоте» 7300 — 5800 м у кроликов U. Stamp (1934) обнаружил липемию. Пребывание кроликов в таких условиях более продолжительный срок (несколько часов) в опытах Mac Lachan P. L. (1939) привело к падению жиров в плазме. У кошек и собак реакция была обратной.
A. Chander et al. (1977) у крыс, подвергнутых в течение 6 час гипобарической гипоксии (290 мм рт. ст.), обнаружили увеличение концентрации свободных жирных кислот в плазме крови с 405 до 607 мэкв/л.
Schmensky (1937) на больших высотах выявил увеличение холестерина в крови человека. Это увеличение он находил не только у прибывших, но и у старожилов гор. L. Barron (1935) и A. Hurtado (1932) у акклиматизированных к горах людей не обнаруживали гиперхолестеринемии.
По данным К. К. Srivastava et al. (1977), содержание холестерина в крови у высокогорных аборигенов южной Индии, проживающих постоянно на высоте 4000 м над уровнем моря, оказалось гораздо ниже (166 мг%), чем у равнинных жителей (220 мг%). При длительном пребывании последних в горах на указанной высоте снижение холестерина в крови до уровня показателей горцев наступало постепенно в течение двух лет.
Следует отметить, что эти наблюдения были проведены в различных горных районах.
В опытах на крысах Soler-Argilaga et al. (1974) обнаружили, что гипоксия значительно изменяет обмен жирных кислот — подавляет их эндогенный синтез, а также, возможно, и их ß-окисление. Отмечено также, что гипоксия усиливает включение в общие липиды печени меченого 14С-пальмитата (экзогенной жирной кислоты), тогда как эндогенные жирные кислоты включались с меньшей интенсивностью. Наиболее заметно внедрение 14С-пальмитата происходило во фракции фосфолипидов и эфиров холестерина. Среди фосфолипидов в этом отношении следует выделить фосфатидилхолины и фосфатидилэтаноламины.
Важные сведения получены в связи с усвоением свободных жирных кислот печеночными клетками в условиях гипоксии. При этом установлено, что перераспределение экзогенных жирных кислот является результатом изменений во внутрипеченочном метаболизме липидов, связанных с обеспеченностью кислородом гепатоцитов.
Кроме того, гипоксия, замедляя липолитические процессы, усиливает синтез триглицеридов и фосфолипидов в печени. Одновременно подавляется синтез холестерина из 14С-ацетата.
Аналогичные результаты получили и A. Chander et al. (1977).
Таким образом, в условиях высокогорной гипоксии, безусловно, происходят определенные сдвиги жирового обмена. Об этом говорит обнаруживаемое многими исследователями увеличение общего жира и его фракций, ацетоновых и кетоновых тел в крови человека в условиях высокогорья и ряд сдвигов в жировом обмене у экспериментальных животных при гипоксии.
Однако нет оснований для резкого ограничения жира в питании. Наоборот, тенденция к превалированию распада жиров над их биосинтезом в определенных условиях, по-видимому, обусловливает необходимость обязательного включения оптимального их количества в дневной рацион.
Мы убедились в этом при опросе большого количества людей, постоянно проживающих в высокогорных местностях или же сравнительно долго пребывающих в этих условиях. Многие из них даже заявили, что порою, они испытывают сильное желание употреблять животный жир, особенно в холодное время года.
В дневном рационе общее количество жира в среднем не отличалось от его содержания в обычных условиях? Наше вмешательство сводилось лишь к нормализации соотношения между жирами растительного и животного происхождения.
На высоте 1700 — 2500 м над уровнем моря для лиц, находившихся в течение двух лет под нашим наблюдением, оптимальным содержанием жира в дневном рационе было 70 — 80 г при энерготрате 3000 ккал при среднем весе тела 65 — 70 кг. То есть, существенного отставания доли жиров в рационе питания не отмечалось. Соотношение между белками, жирами и углеводами соответствовало 1 : 0,9 : 6.
Углеводный обмен
Среди известных молекулярных и клеточных изменений, вызванных гипоксией, основное место занимает нарушение процесса энергообразования. Многие исследователи считают дефицит энергии основным патогенетическим звеном любой формы кислородного голодания (Слоним А. Д., 1956; Кребс К., 1959).
В качестве основного источника энергии организм использует углеводы.
Как известно, в тканях существуют два основных пути распада глюкозы: аэробный и анаэробный. Часть реакции окисления глюкозы не требует присутствия кислорода и поэтому была названа анаэробной фазой: гликолиза. Гликолиз слагается по крайней мере из 11 последовательных ферментативных реакций, в результате которых глюкоза оказывается расщепленной на две молекулы пировиноградной кислоты (Ленинджер А.,. 1974).
В присутствии кислорода пировиноградная кислота подвергается дальнейшему окислению в цикле Кребса. Конечным продуктом этой части окисления глюкозы является углекислый газ и вода.
При недостатке кислорода пировиноградная кислота при участии фермента лактатдегидрогеназы (ЛДГ) и НАД. Н превращается в молочную кислоту.
Гликолиз во время гипоксии, как правило, усиливается, позволяя организму частично восполнить энергию, которой он лишился вследствие нарушения окислительного фосфорилирования субстратов. Повышается активность ферментов гликолиза, увеличивается концентрация молочной и пировиноградной кислот (Путилина Ф. Е., 1967; Кораблев М. Н., Лукиенко П. И., 1976).
Эти положения доказаны углубленными исследованиями последних лет. Так, A. Jacques et al. (1978) у индейцев, живущих на высоте 3800 м (Боливия), по сравнению с европейцами, живущими на равнине, выявили значительные отклонения обмена веществ на этапах анаэробного гликолиза. Результаты этих и ряда других исследований (Kimmla V. L., Hassiner J., 1978) свидетельствуют об адаптивного характера сдвигах энергетического обмена во время продолжительной гипоксии.
Как известно, пусковым ферментом гликолиза является гексокиназа, наряду с фосфорилазой обеспечивающая начальное расщепление гликогена и фосфорилирующая глюкозу за счет АТФ. Но этот ключевой фермент, обеспечивающий максимальную скорость использования глюкозы всем организмом, является наименее «мощным» тликолитическим звеном в цепи гликолиза (Северин С. Е., 1962; Раппопорт С, 1966). Поэтому активность этого фермента в тканях при гипоксии, особенно острой, имеет тенденцию к понижению. Однако по мере адаптации к кислородной недостаточности, особенно у высокоустойчивых особей, она постепенно также повышается (Шумицкая Н. М., 1978).
ЛДГ, являясь ферментом, завершающим гликолиз, может служить хорошим показателем скорости метаболизма по анаэробному или аэробному путям. Поэтому результаты исследования ЛДГ, так же как пировиноградной и молочной кислот, концентрации сахара в крови и моче, указывают на характер катаболизма углеводов в организме в тех или иных условиях.
Еще в 30 — 40-е годы советскими исследователями было установлено, что углеводный обмен, так же как и другие виды обмена веществ, в условиях высокогорья претерпевает определенные изменения (Владимиров Г. Е. с соавторами, 1935 — 1939; Байченко М. Н. и др., 1939).
Так, по Г. Е. Владимирову (1939), при почти неизменной концентрации сахара в крови молочная кислота в последней на высоте увеличивалась. Это авторы объясняли, с одной стороны, мобилизацией сахара из резервов и, с другой стороны, нарушением углеводного обмена.
После сахарной нагрузки при подъеме в горы нарушение углеводного обмена существенно не усугублялось.
Анализ литературных данных говорит о том, что в ответ на высокогорную гипоксию организм мобилизует свои углеводные ресурсы в тканях. Роль депо в этом отношении играет печень. Так, в наблюдениях М. И. Петухова (1958, 1960) при резком подъеме крыс на «высоту» 10 500 м уровень гликогена в печени падал в 5 раз. Параллельно увеличивается концентрация гормонов, повышающих уровень сахара в крови. Так, в первые две недели подъема на высоту 3200 м С. С. Шаповалова (1976) находила увеличение выработки гормонов надпочечников и АКТГ гипофиза.
Есть данные, свидетельствующие о том, что при гипоксии ослабляется эффект инсулина, предотвращаются инсулярные гипогликемии и судороги (Мс Quarrie, Liegker, 1939; Qellhorn et al., 1940). По-видимому, это связано с каким-то антагонистическим влиянием адреналовой системы, ибо у адреналэктомированных животных на высоте инсулин понижал сахар крови (Мс Quarrie et al., 1939).
При непродолжительном пребывании крыс в барокамере с пониженным до 460 — 260 мм рт. ст. давлением на «высоте» 4000 — 8000 м повышение сахара в крови по Ван Лиру (1967) наблюдается лишь в течение первой трети или половины дня.
У акклиматизированных людей, по данным Н. А. Форбес (1936), изменения содержания сахара в крови значительно менее выражены, чем у равнинных жителей, поднявшихся в горы.
В крови атлетов при том же рационе пищи, что и на уровне моря, подъем в горы натощак сопровождался снижением уровня глюкозы в плазме крови с 91,2 до 81,6 мг%, в цельной крови — с 85,3 до 70,7; в эритроцитах — с 77,8 до 63,6 мг% (Picon-Reatagui E. et al., 1970). Однако, несмотря на это, аппетит не повышается, как обычно, а снижается (Picon-Reatagui E., 1963), на высоте 8200 м толерантность к глюкозе была сниженной, а на уровне 3930 м она, наоборот, повышена. По данным Н. К. Das, N. С. Ghosh (1974), после сахарной нагрузки кривая концентрации глюкозы в крови на уровне 4622 м быстрее достигает своего максимума и быстрее падает до исходного уровня, чем на берегу моря (Picon-Reatagui Е., 1963). Видимо, повышенная усвояемость глюкозы в горах есть одна из причин ее пониженной переносимости (Johnson H. L. et al., 1974). Этим, в частности, можно объяснить более частый прием пищи в горах, так как там быстрее развивается голод, но он быстрее и утоляется небольшим количеством пищи. С низким уровнем глюкозы связаны, естественно, и низкие запасы гликогена в печени (Johnson H. L. et al., 1974), на пополнение которых быстро расходуется поступающая глюкоза (Blume F., Pace N., 1969), требуется большое количество инсулина. Однако в условиях высокогорья его уровень даже снижен (Picon-Reatagui E., 1966). Интересно отметить, что у аборигенов на высоте 4540 м после внутривенного введения им фруктозы она подвергалась обмену с участием иных механизмов, чем на уровне моря, значительно быстрее, но по более короткому пути, и не в печени, а непосредственно в тканях, превращаясь в пируват, который переходил в глюкозу (Reynafarje В. et al.; 1969).
Кратковременное увеличение ее содержания в крови, по данным многочисленных исследований, вскоре сменяется гипогликемией. У коренных высокогорных жителей большинство исследователей зачастую обнаруживают пониженную концентрацию глюкозы в крови, но несколько повышенную толерантность к ее внутривенному введению. Наряду с мобилизацией углеводов из их депо в механизме гипергликемии, наступающей в начальные периоды высокогорного восхождения, по-видимому, имеет значение еще и компенсаторно-приспособительное усиление глюконеогенеза. Так, В. В. Поступаев (1976) на основании собственных исследований и обзора большого количества литературных сведений по состоянию углеводного резерва печени и коркового слоя почки, скорости синтеза глюкозы срезами этих тканей, а также характера изменения активности ферментов гликогенеза и гликолиза делает заключение об увеличении скорости глюконеогенеза в организме половозрелых животных в начальных стадиях гипоксии.
Все это убедительно свидетельствует, что материальным субстратом процессов адаптации к условиям высокогорья являются углеводы. Отсюда, казалось бы, вытекает: чем больше в пище углеводов, тем лучше. Действительно, есть работы, подтверждающие такую точку зрения: высокоуглеводистая пища защищает от аноксии (Packard A., 1907), а высокобелковая и высокожировая дает отрицательный эффект (Hove E. L. et al., 1945; Langwill К. et al., 1945). Поэтому подъем в горы лучше переносится, если перед ним питание было высокоуглеводистым (Green M. et al., 1945).
В горах Перу исследователи наблюдали преимущественно углеводистое питание (Picon-Reatagui E., 1962). Однако, несмотря на это, углеводные компоненты крови у обследованных лиц были снижены. Они составляли (в мг%): глюкоза в артериальной крови на уровне моря — 76, а на высокогорье — 53, в венозной крови — соответственно 73 и 52; молочная кислота — 9,96 и 10,8; пировиноградная кислота — 1,51 и 1,64; неорганический фосфат — 3,34 и 4,14; калий — 4,24 и 4,11 (Picon-Reatagui Е., 1962).
Отмеченное характеризует выраженную напряженность углеводного обмена, трудно компенсируемого даже увеличением доли углеводов в диете. В начальной стадии адаптации к условиям высокогорья малопригодна и высокобелковая диета, так как она содержит меньше энергии. В условиях же адаптации к высокогорью, видимо, преимущество за диетой с высоким содержанием жира, а следовательно, и энергии, но это предположение требует соответствующей проверки путем обследования питания аборигенов в экстремальных условиях.
Если литературные данные о характере содержания сахара в крови по мере подъема на большие высоты в основном однотипны, то сведения о молочной кислоте крайне разноречивы. Тем не менее интерес к изучению этого заключительного продукта гликолиза не ослабевает.
Это, по-видимому, объясняется особо важной ролью анаэробного распада углеводов при недостаточной доставке кислорода к тканям, особенно к работающей мышечной ткани, ибо при этих условиях происходит усиленный распад гликогена с образованием молочной кислоты.
Первые сведения об изменении концентрации в крови молочной кислоты при подъеме на высоту обнаруживаем еще в литературе конца прошлого и начала нынешнего века (Araki Т., 1891; Saiki М., Wakayama G., 1901; Barcroft J., 1922).
Общепризнано, что кислородное голодание способствует усиленному образованию молочной кислоты в организме.
Однако не все исследователи обнаруживали как сам факт усиленного образования молочной кислоты на высоте (Sundstroem E. S., 1935), так и ее накопление (Брусиловская Д. А., 1937; Владимиров Г. Е. с соавторами, 1935).
Так, Д. А. Брусиловская (1937) и Г. Е. Владимиров с соавторами (1935) даже после мышечной работы на большой высоте не обнаруживали нарастания уровня молочной кислоты в крови, что объясняли нейтрализующим влиянием параллельно развивающегося дыхательного алкалоза. А. V. Bock et al. (1932), В. Dill et al. (1937), Edwards (1936) и Reys (1936) обнаружили, что после физической нагрузки на высоте 3660 и 4570 м содержание молочной кислоты в крови ниже, а на высоте 6000 м несколько выше, чем у наблюдаемых на уровне моря.
Д. Баркрофт (1927) установил, что концентрация молочной кислоты в крови увеличивается по мере подъема в горы в 2 — 3 раза по сравнению с показателями, зафиксированными на уровне моря, а именно: от 13 мг% на уровне моря до 18 мг% на высоте 2900 м и до 39 мг% — на высоте 4560 м.
Нарастание молочной кислоты при гипоксии обнаружили также Н. Н. Сиротинин и Е. М. Тимофеев (1933), И. П. Байченко и А. Н. Крестовников (1933), И. М. Дедюлин (1941), А. Н. Крестовников (1951), Н. Н. Яковлев (1955), Е. Н. Домонтович (1957).
Однако многие исследователи вовсе не обнаруживали увеличения молочной кислоты в крови даже на высоте 3000 — 5000 м (Брусиловская Д. А., 1937; Ryffel L. Н., 1910, 1910 a; Saguer Z., 1919, 1924; Sundstroem E. S., 1919; Bock A. V. et al., 1932; Harfman V., Muratt A., 1934).
Указанные разногласия, по-видимому, объясняются разной степенью тренированности наблюдаемых, а также различной мышечной нагрузкой в период обследования.
Обнаруживаемое увеличение содержания молочной кислоты в крови в условиях высокогорья, по-видимому, является проявлением тканевой акклиматизации (Барбашова 3. И., 1960; Бернштейн А., 1967).
Исследования Эльбрусской экспедиции 1934 года (Владимиров Г. Е. и др., 1936) показали, что наряду со значительным возрастанием на больших высотах (4250 — 5315 м) уровня молочной кислоты в крови у людей в условиях мышечного покоя наблюдается, наоборот, очень незначительное изменение в уровне молочной кислоты крови при кратковременной напряженной работе и особенно при продолжительном, связанном с восхождением мышечном напряжении.
Этот парадоксальный факт был подтвержден при лучшей методической постановке работы систематическими исследованиями содержания молочной кислоты крови у одних и тех же наблюдаемых на различных уровнях высот в Эльбрусской экспедиции 1935 года (Владимиров Г. Е. с соавторами, 1938). По-видимому, при мышечной работе в условиях разреженной атмосферы происходит сдвиг в химической динамике общего обмена, заключающийся либо в большем удалении молочной кислоты, либо в меньшем уровне ее образования.
С другой стороны, повышение на высотах содержания молочной кислоты в крови у подопытных, находящихся в состоянии мышечного покоя, может быть рассмотрено как компенсаторное явление, необходимое для регуляции активной реакции крови.
Т. Е. Fridemann (1949) наблюдал, что на высоте 4570 м наряду с молочной кислотой избыточно образуется также и пировиноградная кислота. Коэффициент же их соотношения при этом увеличился.
В организме крыс, пребывавших в течение 9 дней по нескольку часов в барокамере с пониженным давлением,, соответствующим высоте 2200 м, Groza P. et al. (1975). отмечали повышение концентрации лактата и пирувата, уменьшение НАД и НАД.Н, образование АТФ. Это свидетельствовало о неэффективной утилизации глюкозы. Концентрация ЛДГ при этом практически не изменялась.
В наших исследованиях у людей, длительно находившихся на разных высотах (600, 1700, 2500 м над уровнем моря), содержание молочной и пировиноградной кислот в крови в состоянии покоя существенно не отличалось, друг от друга и колебалось в пределах 9 — 15 мг%. Между тем отмечена некоторая тенденция к повышению концентрации лактата по мере увеличения высоты над уровнем моря. Существенные изменения в первые дни отмечались при физической нагрузке. В состоянии же покоя у вновь прибывших в горы существенных отличий от исходных величин зачастую мы не обнаруживали.
При подъеме одних и тех же лиц на вышеуказанные высоты в первые 3 — 4 дня в ряде случаев отмечалась даже некоторая тенденция к снижению в крови содержания молочной кислоты в состоянии покоя. Это, возможно, объясняется резким активированием трансаминазы и усиленным переводом пировиноградной кислоты не в молочную кислоту, а в аминокислоту аланин. Следует, однако, отметить, что даже в состоянии покоя при исследовании через 14 дней у всех наблюдаемых в крови заметно увеличивалось содержание молочной кислоты и ЛДГ. При этом отмечено уменьшение пирувата (табл. 2).
Поскольку в покое по содержанию в крови лактата и пирувата не всегда было возможно судить о мощности анаэробных путей окисления, как было указано выше, определяли эти показатели после стандартной физической нагрузки на велоэргометре.
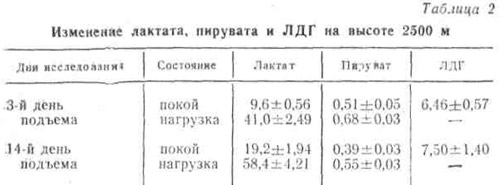
Как видно из табл. 2, после нагрузки в крови резко увеличилось содержание молочной кислоты. Это увеличение было существенно как в первые дни, так и через две недели после пребывания на высоте.
Все это указывает на усиление анаэробного пути дыхания. Как известно, последний с энергетической точки зрения является маловыгодным. Однако он в условиях гипоксии является вынужденной мерой приспособления.
Эта метаболическая перестройка, как и любая компенсаторно-приспособительная мера организма, выгодна в данной ситуации лишь при оптимальном варианте протекания. Усиление этого механизма без достаточного обеспечения необходимыми компонентами, надо полагать, чревато излишним накоплением шлаков и выделением меньшей энергии с вытекающими из этого последствиями. Следовательно, адекватное питание в этих условиях должно приобретать одно из первостепенных значений. Для выяснения данного вопроса нами было проведено исследование вышеуказанных параметров углеводного обмена в наблюдениях на людях, получавших различное питание, и в эксперименте на животных.
Как было указано выше, рекомендованное нами питание выгодно отличалось от питания контрольных групп, т. е. от так называемого фактического питания, более адекватным количественно-качественным содержанием важнейших нутриентов и лучшей усвояемостью пищи в этих необычных условиях обитания.
Соотношение между белками, жирами и углеводами составляло 1:1:6. Квота углеводов была увеличена преимущественно за счет легкоусвояемых их видов — моносахаридов. Белки и жиры животного и растительного происхождения сбалансированы. Питание стало более полноценным по сравнению с существующим рационом и по витаминному, и по минеральному составам.
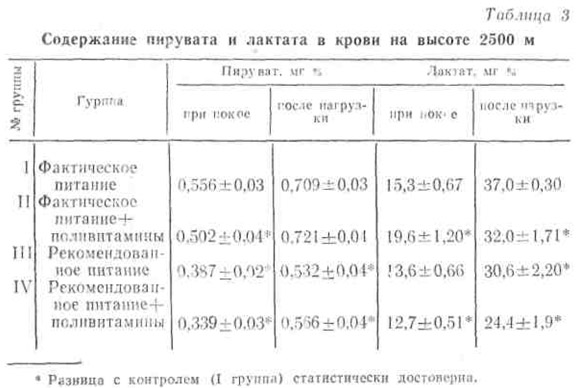
В табл. 3 представлены сведения о содержании пировиноградной и молочной кислот в крови людей, находившихся на различном рационе питания на высоте 2500 м над уровнем моря.
Как видно из таблицы, количество пирувата и лактата меньше у лиц, находившихся на рекомендованном питании. Такая же картина отмечалась после нагрузки на велоэргометре мощностью 610 Вт в течение 6 мин. Это, по-видимому, указывает на сравнительно лучшее превращение углеводов на этапе аэробного окисления, вследствие чего пируват и лактат поступают в кровь в меньшем количестве. Еще более выраженную закономерность мы отметили при исследовании на высоте 3600 м.
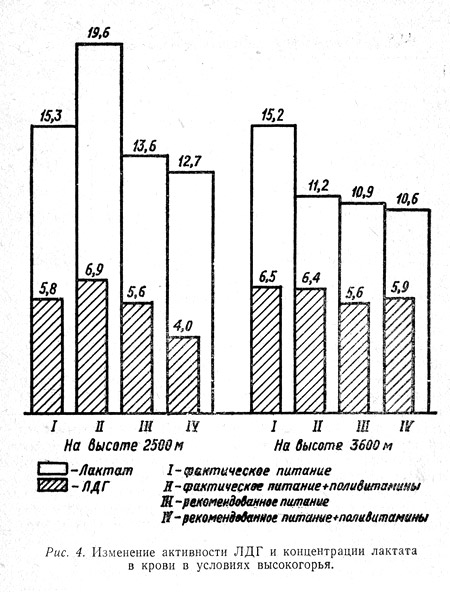
При этом отмечено, что активность лактатдегидрогеназы и содержание молочной кислоты в крови находятся в прямой зависимости (рис. 4). Так, на высотах 2500 и 3500 м в покое меньшее количество лактата и сравнительно низкая активность фермента ЛДГ были в группах, находившихся на рекомендованном питании, особенно в группе, получавшей на фоне последнего дополнительное количество витаминов (IV группа).
То есть в этой группе, по сравнению с другими, в меньшей степени страдал аэробный путь окисления углеводов. Иными словами, больше образовывалось энергии, а следовательно, можно допустить, что все жизненные функции организма наблюдаемых этой группы должны страдать в сравнительно меньшей степени. Результаты других наших исследований подтверждают эту мысль.

Более углубленные исследования углеводного обмена в эксперименте, в частности результаты определения активности ряда ферментов, также говорят об этом.
Как было указано выше, в эксперименте на животных, у которых вызывали гипоксическую гипоксию, были довольно подробно изучены различные аспекты обмена веществ, в том числе и отдельные показатели углеводного обмена. Однако вышеупомянутые параметры этого обмена при различном характере питания мало изучены. Между тем выяснение происходящих сдвигов именно этих показателей при рекомендованном нами питании с преимущественно углеводистой ориентацией имело бы определенный смысл. Ибо, как известно, в условиях гипоксии к метаболическим компенсаторно-приспособительным перестройкам организма в большей степени причастен углеводный обмен. Следовательно, уровень поступления извне углеводов тем или иным образом должен отразиться на этой перестройке. Эти углубленные исследования возможны лишь в эксперименте на животных. Исходя из сказанного, мы вели наблюдения над отдельными группами животных (белые крысы), получавших различный рацион питания в условиях барокамерной и высокогорной гипоксии. Одна часть животных получала обычный полусинтетический сбалансированный рацион, другая находилась на предложенном нами рационе, который по аналогии с описанным выше рекомендованным для людей питанием имел углеводную ориентацию. Каждая из этих групп подразделялась еще на две, одна из которых не получала, а другая получала двойную дозу витаминов А, В1 В2, С, РР, Е. Таким образом, под наблюдением находилось четыре группы животных (табл. 4). Все эти животные были подняты на высоту 3340 м над уровнем моря, а у части из них ежедневно вызывали барокамерную гипоксию. Исследование отдельных показателей обмена веществ было проведено через 14 дней от начала наблюдения.
Сопоставление с данными литературы и исходными величинами, установленными нами же на равнине, показывает, что при подъеме на высоту 3340 м наступившее в первые дни резкое снижение гликогена в органах в последующем менее выражено. Уменьшение, хотя и в меньшей степени выраженное, чем в первые дни, имело место и в конце второй недели. Как видно из табл. 4, в печени это уменьшение было сравнительно менее выражено в группах, получавших рекомендованный нами рацион питания с повышенным содержанием легкоусвояемых сахаров. Более высокий уровень отмечен в группе, получавшей на фоне рекомендованного питания дополнительное количество витаминов (IV группа). Примерно такой же характер изменения установлен и в ткани бедренной мышцы исследованных животных. В барокамерных опытах не всегда обнаруживались закономерности, идентичные с натурными наблюдениями. Так, в отличие от натурных опытов относительно большее содержание гликогена отмечено в печени и мышцах крыс, получавших обычный рацион, чем рекомендованный. Эти различия, по-видимому, обусловливаются прежде всего разной степенью гипоксического состояния. В частности, в барокамерах создавали разрежение, соответствующее «высоте» 7000 м над уровнем моря, тогда как в горы поднимали крыс на высоту 3400 м. Кроме того, имеется одно очень важное обстоятельство, которое не всегда учитывается в барокамерных опытах и которого практически пока что трудно избежать. Это методическая погрешность, связанная с исследованиями не непосредственно в барокамере, а вне ее, после выхода из условий разреженного воздуха, тогда как в натурных опытах пробы берутся непосредственно в гипоксическом состоянии. Но как бы то ни было, результаты наших исследований показывают, что более оптимальное углеводное снабжение тканей, а именно: сравнительно лучшее откладывание его запасов, обеспечивается при углеводистой ориентации рациона с дополнительным введением в организм биологически активных катализаторов метаболических процессов — витаминов.
В этой же группе животных как в горах на высоте 3400 м, так и при барокамерной гипоксии обнаружена сравнительно меньшая концентрация лактата и пирувата в крови. При этом снижение количества пирувата в горах происходило более интенсивно. Поэтому коэффициент лактат — пируват имел тенденцию к увеличению, тогда как при барокамерной гипоксии, наоборот, этот показатель уменьшился. Эти различия, по-видимому, также обусловлены особенностями опыта.
Активность лактатдегидрогеназы была низкой у подопытных крыс, получавших рекомендованный рацион с увеличенной долей легкоусвояемых углеводов. При введении дополнительного количества витаминов отмечалось снижение активности ЛДГ во всех группах. Это свидетельствует об улучшении обмена веществ, направленного на уменьшение интенсивности гликолитического процесса как менее выгодного пути выработки энергии.
Данные литературы о подобном действии витаминов известны (Алексеев А. М., Ткаченко А. В., 1965; Яковлев П. Н., 1967; Народанская Ф. А., 1967; Рунг Г. Р., 1972; Сиротинин Н. П., 1973). Однако в условиях высокогорья и на фоне различного общего питания эти исследования проводились впервые нами. При этом было замечено, что при витаминизации на фоне рациона с углеводистой ориентацией, по сравнению с остальными наблюдаемыми группами, активность ЛДГ снижалась во фракции цитоплазмы многих внутренних органов, что может быть обусловлено усилением интенсивности окислительных процессов в тканях и большим переводом пирувата в цикл трикарбоновых кислот. Таким образом, как показали наши данные, скорость катаболизма углеводов по гликолитическому пути зависит от характера питания. Адекватный для условий высокогорья рацион питания с углеводистой ориентацией, с достаточным содержанием белков, жиров, минеральных солей и с дополнительным введением витаминов способствует более эффективному протеканию аэробных путей превращения энергии.
Известно также, что реакции первой половины цикла трикарбоновых кислот наиболее чувствительны к дефициту кислорода (Михайлов Г. А., 1971; Прохорова М. И. и др., 1973; Бойко О. А. и др., 1978). По-видимому, этим и объясняется характер изменения активности изоцитратдегидрогеназы в наших исследованиях.
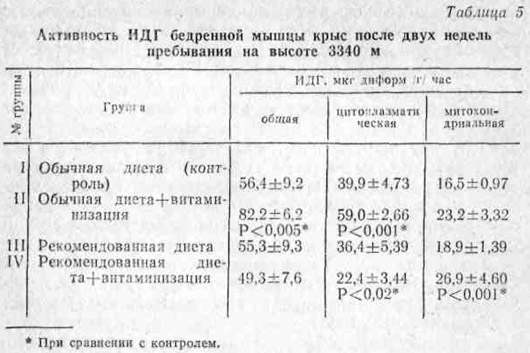
Как известно, в скорости протекания цикла Кребса фермент изоцитратдегидрогеназа (ИДГ) имеет большое значение. Он как бы запускает этот процесс. Как видно из данных табл. 5, общая активность ИДГ в ткани бедренной мышцы при рекомендованном питании по сравнению с контролем практически не изменилась. При дополнительной витаминизации на этом фоне она даже имела, тенденцию к снижению, что, по-видимому, говорит о большем переключении интенсивности реакций цикла Кребса на второй его период. На фоне же обычной полусинтетической диеты такая же витаминизация, наоборот, резко повысила данный показатель.
Последнее можно было бы рассматривать как положительное явление, способствующее энерговыработке в результате усиления метаболизма. Однако сравнение по фракциям дает другую закономерность. В частности, во фракции митохондрий была более высокая активность ИДГ у крыс, получавших рекомендованный рацион, чем у контрольных животных. В этом отношении дополнительная витаминизация более благоприятно сказалась на фоне рекомендованного рациона. В цитоплазме соотношение активности ИДГ между группами имело зависимость, характерную для гомогената. Следовательно, резкое увеличение общей и цитоплазматической активности ИДГ бедренной мышцы на высоте у крыс, находившихся на обычной диете, по-видимому, можно объяснить некоторой утечкой фермента из митохондрий в цитоплазму.
В таком случае можно ожидать торможения процесса дегидрирования изолимонной кислоты в цикле трикарбоновых кислот, так как реакции в нем обычно идут строго последовательно и пространственно ограничены мембранными структурами. Между тем известно, что дегидрогеназы, имея преимущественную митохондриальную локализацию, именно в этих субклеточных органеллах осуществляют свои функции.
Наименьшая активность ИДГ в цитоплазме и наибольшая в митохондриях групп рекомендованного питания, особенно у получавших двойную дозу витаминов, на этом фоне говорит о более стабильной связи этого фермента с мембранными структурами. Такую же закономерность мы наблюдали при исследовании активности малатдегидрогеназы (МДГ).
Как известно, в условиях гипоксии происходит накопление восстановленных потенциалов (Юрков Ю. А., Сафролов Т. Я., 1976). Поэтому активация путей, способных окислять НАД.Н, имеет определенное адаптивное значение. Одним из главных путей активации является путь переноса восстановленных потенциалов в митохондрии из цитоплазмы за счет функционирования малат-оксалатного шунта (Хочачка П., Сомеро Дж., 1977; Ньюсхолм, Старт К., 1977). МДГ в митохондриях способствует окислению восстановленного соединения — малата в оксалоацетат. Последний, выйдя в цитоплазму, в свою очередь окисляет восстановленный НАД и, снова превращается в малат. Поэтому малатдегидрогеназа в условиях гипоксии может способствовать не только поставке энергии путем активации цикла трикарбоновых кислот, но и уменьшению восстановленных потенциалов. Активность малатдегидрогеназы в мышечной ткани крыс, находившихся в течение двух недель на высоте 3340 м над уровнем моря, в наших наблюдениях повысилась во всех группах. Однако исследования по фракциям показали, что по сравнению с контролем в группе, находившейся на рекомендованном питании с дополнительным введением витаминов, повышение активности МДГ отмечалось преимущественно в митохондриях. Однако в наших опытах активность всех исследованных ферментов, причастных к циклу трикарбоновых кислот, имела однонаправленное изменение.
По утверждению ряда авторов (Кондрашова М. Н., 1967, 1969; Идельсон Л. И., 1968), при гипоксии может иметь место переключение окислительных превращений на уровне цикла трикарбоновых кислот НАД-зависимых субстратов в сукцинат, благодаря чему устраняется в той или иной мере дефицит макроэргических соединений.
Активация СДГ также может усиливать синтез гемохромопротеидов, тем самым стимулируя адаптогенные возможности организма при гипоксической гипоксии (Идельсон Л. И., 1968).
Следовательно, обнаруженную нами сравнительно низкую активность СДГ в подопытных группах, по-видимому, можно объяснить меньшей степенью гипоксии в этих группах в связи с улучшением метаболических процессов вследствие рационализации питания. Примерно такие же закономерности в изменениях активности были отмечены в мозговой, печеночной и почечной тканях.
Таким образом, в мышечной и мозговой тканях крыс при пребывании животных в течение 14 дней на высоте 3340 м над уровнем моря обнаружена некоторая активация дегидрогеназ цикла трикарбоновых кислот. При скармливании животным рациона с увеличенной долей легкоусвояемых углеводов и с повышенной дневной физиологической дозой витаминов несколько улучшается нарушенная под влиянием гипоксии стабильность связи указанных ферментов с мембранными структурами. В частности, при рекомендованном питании отмечалась более стабильная связь ферментов с митохондриями мембран, что значительно увеличивает их возможность функционировать в цикле.
Результаты исследования вышеуказанных ферментов при барокамерной гипоксии во многом соответствовали результатам натурных наблюдений в горах, что указывает на главную этиологическую роль кислородной недостаточности в обнаруженных сдвигах. Однако у нетренированных к барокамерной гипоксии крыс после первого «подъема» на большую «высоту» (7000 м) отмечали зачастую понижение активности ферментов. По-видимому, у животных в этот период пока что вовлекаются преимущественно функциональные меры приспособления, что не всегда идет параллельно с тканевыми механизмами адаптации, которые вступают в действие, как правило, позднее. Видимо, этим и объясняются обнаруженные нами особенности характера изменений тканевых ферментов. Этим и ценны методы изучения долгосрочных механизмов адаптации для выработки определенных предложений по рационализации в условиях высокогорья.
Результаты наших исследований, а также анализ литературных данных позволяют утверждать, что в условиях сравнительно длительной гипоксии усиливается использование пировиноградной кислоты в трансаминировании с глутаматом. Это повышает роль гликолитического пути расщепления углеводов в процессах энергообразования, ограничивает синтез жира, переключает интенсивность реакций цикла Кребса на второй период. Такая мера метаболической адаптации способствует экономному использованию кислорода и более активному транспортированию его к тканям.
Таким образом, характер обнаруженных нами сдвигов углеводного обмена в сопоставлении с описанными в предыдущих разделах белковым и жировым обменами в определенной степени подтверждает некоторое преимущество углеводной ориентации питания в условиях гипоксической гипоксии.
Подтверждение этой мысли на таком уровне исследований находим мы и в некоторых работах зарубежных авторов. Так, канадские исследователи Orrego H. et al. (1978) обнаружили, что у крыс выраженность гепатоцеллюлярного некроза в концевых дольках печени и изменения активности глутаматтрансаминазы, наступавшие при гипоксии, уменьшались при увеличении доли жиров. Белковое же питание, наоборот, усилило эти нарушения.
Как видим, авторы наряду с положительной ролью углеводов считают нежелательным высокое содержание белка в рационе при гипоксии.
С этими наблюдениями в определенной степени перекликаются результаты исследований ученых Манчестерского университета (Smith S. A. et al., 1978), которые установили, что скорость столь необходимого в условиях типоксии глюконеогенеза в изолированных гепатоцитах после внесения в инкубационную среду триптофана значительно подавлялась.
Обмен витаминов
Данные литературы по обмену витаминов и обеспеченности ими в условиях высокогорья разноречивы.
Так, в пустыне Атакама на высоте 4000 — 4500 м у индейцев-аборигенов не зарегистрировано признаков авитаминоза, хотя в их рационе суточное потребление витаминов А, С, Д было незначительным, а ночное зрение у наблюдаемых — прекрасное. Нет рахита и цинги (Hougaard A., 1968).
Интересно, что в процессе адаптации в горах повышается потребность в витамине С в большей степени у мужчин, нежели у женщин (Брагинский Б. М., 1966). Причем такая тенденция отмечалась в течение двух лет наблюдения. Однако у аборигенов эта потребность была снижена постоянно. Подобное отмечено и у горцев Кавказа (Цховребова 3. А., 1968).
Уменьшение содержания некоторых витаминов в крови отмечено в условиях высокогорного курорта Аджикент (Гасанов Ш. М., Кочергина Е. К., 1963).
Исследованиями ряда отечественных и зарубежных ученых установлено, что в механизмах адаптации к экстремальным условиям особое значение имеют витамины (Космолинский Ф. П., 1956, 1961; Брагинский Б. М., 1963, 1966; Челнокова Н. А., 1966; Парменов-Трифилов Б. И., Беледа Р. В., 1974). Это и понятно, так как большинство из этих биологически активных нутриентов являются мощными естественными биокатализаторами окислительно-восстановительных процессов в тканях организма.
В этом отношении особого внимания заслуживают водорастворимые витамины, большинство которых входит в коферментные системы клеточного дыхания.
В литературе имеются многочисленные указания на благоприятное воздействие на организм отдельных витаминов и их комплексов в условиях кислородного голодания.
Естественно, такое благоприятное влияние в каждом конкретном случае зависит от механизма действия отдельных витаминов. Наряду с этим, по-видимому, имеется нечто общее между их действием. Так, Л. М. Карпов с соавторами (1977) положительную роль большинства водорастворимых витаминов при гипоксии объясняют их способностью фиксировать в тканях СО2 и стимулировать активность пируватдегидрогеназы.
Выживаемость мышей и крыс, предварительно получавших витамины В1 В2 и РР, в опытах Ю. Ф. Удалова (1956) была выше, чем в контроле при подъеме их на высоту. Причину этого автор связывает с обнаруженным им фактом влияния указанных витаминов на активность ферментов дегидраз и цитохромоксидаз. Последние обычно при гипоксии снижаются. Витамины В1, В2 и РР предупреждали такое снижение.
С точки зрения интересующих нас вопросов заслуживают определенного внимания результаты наблюдений Ф. П. Космолинского (1956, 1961), Б. М. Брагинского (1963, 1966), Н. А. Челноковой (1966), И. П. Неумывакина с соавторами (1973), Б. И. Парменова-Трифилова и Р. В. Беледы (1974) и других, которые обнаружили, что по мере возрастания степени гипоксии как в барокамере, так и в горах зачастую потребность в водорастворимых витаминах повышалась.
В то же время, исходя из современных представлений о межнутриентных взаимоотношениях, нельзя рассматривать роль витаминов в условиях высокогорья без учета общего фона питания. Поэтому мы в своих исследованиях пытались изучить обеспеченность организма отдельными витаминами при различном характере питания у людей и экспериментальных животных, пребывающих на разных высотах. Ниже приводятся результаты исследования тех витаминов, обеспеченность которыми в наибольшей степени была подвержена нарушениям в условиях высокогорья.
Витамин А. В доступной литературе прямых указаний на нарушение обмена витамина А в организме в условиях высокогорья и гипоксической гипоксии нет.
Н. А. Вишневский и Б. А. Цырлин (1935) обнаружили, что на высоте, начиная с 1500 м над уровнем моря, понижается световая, цветовая и электрическая чувствительность глаза. Причем было замечено, что эти отклонения тем более выражены, чем больше высота. Цветовые объекты, видимые на больших высотах (4500 и 6000 м), казались менее насыщенными. Ослабление насыщенности иногда доходило до полной потери восприятия цвета. Механизм указанных отклонений исследователи не изучали. Однако они были склонны считать, что эти сдвиги обусловлены действием гипоксии прежде всего на центральную нервную систему. Одним из часто применяемых тестов, косвенно характеризующих А-витаминную обеспеченность организма, как известно, является изучение функции зрения. Однако ее сдвиги в. условиях высокогорья многие считают непрямым следствием нарушения метаболизма витамина А. О. В. Соловей (1939) и В. В. Стрельцов (1938) на основании результатов своих исследований пришли к такому же выводу. В их наблюдениях при «подъеме» на «высоту» 1500 м в первую очередь ухудшалось цветовосприятие, т. с. филогенетически сравнительно молодая функция (функция колбочек), в то время как ухудшение более древней светоразличающей (палочковой) функции глаза наступало значительно позже.
Судя по этим данным, следовало бы заключить, что изменения функции зрительного анализатора в условиях высокогорья непосредственно не обусловлены действием витамина А. Однако, исходя из современных представлений о роли витамина А и его различных фракций, а также учитывая зависимость их обмена от других нутриентов, мы не могли удовлетвориться вышеуказанным однозначным ответом. Этот важный пищевой фактор, имеющий широкий спектр биологического действия, по-видимому, имеет определенное значение в адаптационно-приспособительном механизме организма в условиях высокогорья.
В связи с этим особенно следует отметить открытие за последние годы так называемых ретинолсвязывающих белков (РСБ).
Эти специфические белки участвуют в транспортировании ретинола кровью к различным органам и тканям с последующей рецепцией ретинола и его производных клетками органов-мишеней.
Взаимодействие ретинола с РСБ имеет очень важное физиологическое значение. Благодаря этой связи, с одной стороны, защищается витамин А от деградирующего воздействия других факторов, с другой — РСБ предотвращает, очевидно, мембранотоксические эффекты свободного ретинола. Последнее, как мы знаем, особенно важно в экстремальных условиях, в том числе и при гипоксических состояниях, когда мембраны клеток и субклеточных органелл испытывают повреждающие воздействия различных факторов, образующихся вследствие метаболических сдвигов.
Причинами же изменения содержания РСБ могут быть алиментарные нарушения, в частности недостаток витамина А, белка, цинка и пр. (Натансон А. О., Конь И. Я., 1979; Muto Y. et al., 1972; Smith E. R. et al., 1973, 1973 a, 1975; Smith Y. et al., 1973; Ingenbleek Y., 1975).
Таким образом, витамин А и ретинолсберегающий белок должны играть существенную роль в организме человека при пребывании его в условиях высокогорья. Кроме того, учитывая то обстоятельство, что обеспеченность витамином А в значительной степени зависит от сбалансированности других составных частей питания, количественное исследование всех названных факторов представляется весьма актуальной задачей.
Поэтому нами было изучено влияние высокогорья на обеспеченность организма витамином А на фоне различного характера питания.
Исследования были начаты с изучения некоторых показателей обеспеченности организма витамином А. С этой целью определено на разных высотах содержание этого витамина и каротина в сыворотке крови, исследованы функции зрения и ряд физиологических параметров, косвенно характеризующих эту обеспеченность.
Концентрация витамина А в сыворотке крови здорового взрослого человека в обычных равнинных условиях, по самым последним данным, находится в пределах от 40 до-70 мкг% (Дмитровский А. А., 1979).
В наших исследованиях, проведенных в условиях города Алма-Аты, находящегося на высоте 650 м над уровнем моря, содержание витамина А в сыворотке здоровых молодых мужчин соответствовало вышеуказанным величинам. У этих же лиц при исследовании сразу же после подъема на высоту 1700 м концентрация витамина А снизилась до 27 мкг%. Содержание каротина на этой высоте соответствовало 110 — 140 мкг%. Через три дня после подъема эти величины соответственно равнялись 30 — 40 мкг% и 110 — 143 мкг%. На высоте 2500 м произошло дальнейшее снижение витамина А без изменения каротина (рис. 5).
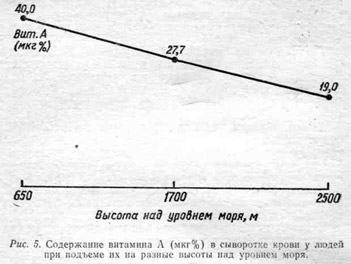
При дальнейшем наблюдении, начиная со второго дня подъема на новые высоты, отмечались некоторые сдвиги в сторону нормализации содержания витамина А. Однако при наблюдении в течение 2 — 3 недель так и не наступало полного восстановления исходных величия.
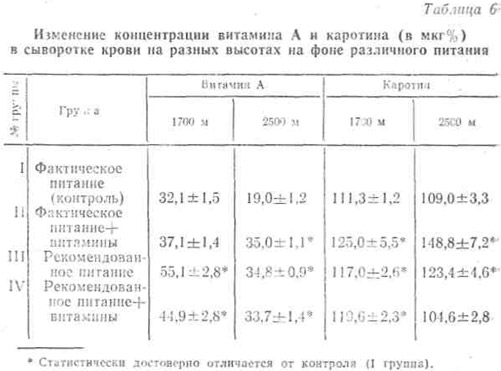
Поэтому часть наблюдаемых ежедневно получала в течение 3 месяцев дополнительно по 750 мкг витамина А как в составе поливитаминного комплекса, так и в отдельности. Однако, как видно из табл. 6, нормализация концентрации витамина А на высоте 1700 м наступала лишь в группах, находившихся на рекомендованном нами питании с рациональным белково-жировым и углеводным количественно-качественным соотношением.
На высоте же 2500 м дополнительное получение витамина А как на фактическом, так и на рекомендованном фоне питания не привело к полной нормализации его содержания в крови.
Как видно, содержание каротина в крови наблюдаемых контрольной группы по мере подъема не претерпевало изменений.
У получавших дополнительное количество витамина А, а также находившихся на рекомендованном питании отмечено некоторое увеличение его содержания.
Это, по-видимому, можно объяснить не только лучшей обеспеченностью витамином А этих групп по сравнению с контролем, но и некоторым затормаживанием дальнейшего метаболизма этого провитамина в условиях высокогорья.
Менее выраженные сдвиги в содержании витамина А в крови на фоне рекомендованного питания, по-видимому, прежде всего объясняются сбалансированием белкового состава пищи. В частности, в рекомендованном питании нами, по сравнению с фактическим, был сбалансирован аминокислотный состав за счет нормализации соотношения белков животного и растительного происхождения. Положительная роль рационализации белкового питания в обмене витамина А была доказана работами многих отечественных и зарубежных исследователей (Тарьян Р., 1958; Леутский К. М., 1959; Натансон А. О., 1961; Алдашев А. А., 1972; Шарманов Т. Ш., 1979).
Что касается отсутствия полной нормализации во всех группах содержания витамина А на высоте 2500 м, то это, по-видимому, указывает на недостаточность рекомендованного дополнительного количества этого витамина. Отметим, что для высоты 1700 м оно было достаточным.
Результаты исследований функций зрения в основном соответствовали этим данным.
Так, при изучении темновой адаптации на высоте 2500 м отмечено снижение конечных величин светочувствительности и увеличение их колебаний (1,63 — 3,06).
Дополнительная А-витаминизация и рационализация общего фона питания существенно не улучшили эти показатели. Однако отмечено, что начальные величины световой чувствительности меньше страдают в группе, получавшей витамин А на фоне рекомендованного нами питания. В остальных группах они были снижены.
Витамин В1. Исходя из особенностей физиологической роли витамина В1 следует подчеркнуть особую важность обеспеченности организма им в условиях высокогорья.
Это прежде всего объясняется существенной ролью витамина В1 в углеводном обмене (Кржановская И. И., 1967; Ефремов В. В., 1969; Островский Ю. М., 1979).
Как известно, в организме тиамин находится главным образом в виде тиаминдифосфата и в меньшей степени — монофосфата и трифосфата. Тиаминдифосфат — простетическая группа ферментов, участвующих в важнейших звеньях углеводного обмена: дегидрогеназы пировиноградной кислоты, дегидрогеназы α-кетоглутаровой кислоты и транскетолазы. В частности, он действует как кофермент в системе транспектолазы, связанной с прямым окислительным путем глюкозы.
Для окислительного превращения пировиноградной кислоты необходимо наличие фермента, простетическая группа которого — кокарбоксилаза — представляет собой пирофосфорный эфир тиамина (витамина В1). Следовательно, при гиповитаминозе В1 может накапливаться пировиноградная кислота. Накапливается также и молочная кислота. Ибо, с одной стороны, избыток пировиноградной кислоты сопровождается большим образованием из нее молочной кислоты, а, с другой стороны, сам тиамин непосредственно причастен к дальнейшему метаболизму лактата.
J. Krusius, V. Simola, изучая влияние всех известных витаминов, пришли к выводу, что лишь тиамин играет наибольшую роль в превращении пировиноградной кислоты в молочную и в дальнейшем метаболизме последней (Кржановская И. И., 1967).
Недостаток же этого витамина часто имеет место, как известно, при преимущественно углеводистой пище, особенно при увеличении доли легко всасываемых углеводов. Если же придерживаться при выборе меню в условиях высокогорья преимущественно углеводистой ориентации, особенно с увеличением легко перевариваемых углеводов, то становится понятным, как при этом может сложиться ситуация, предрасполагающая к дефициту тиамина в организме.
Кроме того, известно, что вообще экстремальные условия быстро истощают и без того скудные запасы витамина В1 в организме (Ефремов В. В., 1969). Как видим, в условиях высокогорья, особенно при рекомендуемой обычно в этих условиях углеводистой ориентации питаний, складывается реальная возможность развития резкого дефицита тиамина.
Поэтому, возможно, и не случайно, что симптомы горной болезни и недостаточности тиамина во многом идентичны: потеря аппетита, тошнота, рвота, запоры, адинамия, судороги и слабость мышц, учащение сердцебиения, одышка при значительном физическом напряжении, раздражительность, ослабление памяти.
Мы в своих исследованиях нередко обнаруживали снижение уровня содержания витамина В1 в крови по мере подъема на высоту. Это снижение еще более отчетливо выражено было у тех людей и экспериментальных животных, которые получали питание преимущественно углеводистой ориентации с увеличением доли легко всасываемых сахаров-моносахаридов.
При этом наиболее благоприятные сдвиги, как в смысле тиаминовой обеспеченности, так и других показателей состояния организма наблюдались на фоне общей рационализации питания при увеличении дневной профилактической дозы этого витамина в среднем до 2 — 3 раз.
Витамин В2 (рибофлавин). В литературе имеются указания на изменения активности дегидрогеназ, оксидаз, цитохромредуктаз и ряда других ферментных систем в условиях гипоксической гипоксии, в том числе и при высокогорной гипоксии. Как известно, рибофлавин входит в состав вышеупомянутых ферментных систем в виде соединений рибофлавинмононуклеотида и рибофлавинадениндинуклеотида с белками или с минеральными веществами. Зачастую активность этих ферментов в начальных стадиях гипоксической гипоксии повышается. Так, по данным Б. М. Брагинского (1968), в первые дни и недели пребывания в условиях высокогорья у людей активность фермента сукцинатдегидрогеназы, коферментом которой является флавинадениндинуклеотид, возрастает. Параллельно с этим понижалась обеспеченность организма витамином В2. В наших наблюдениях на людях подъем в горы сопровождался снижением уровня рибофлавина в крови с некоторой тенденцией к увеличению его содержания в моче. Дополнительное получение поливитаминов, особенно на фоне рационального питания, в условиях среднегорья способствовало нормализации содержания витамина В2 в крови и моче.
Однако такая зависимость обеспеченности витаминами, В1 и В2 от фона питания, особенно в условиях высокогорья (2500 и 3600 м), была менее отчетливой по сравнению с витаминами С и Е.
Витамин С. В настоящее время в литературе имеется довольно большое количество данных, указывающих на изменение обеспеченности организма витамином С, а следовательно, и потребности в нем в условиях гипоксической гипоксии вообще и при высокогорной гипоксии в частности.
Я. Э. Бронштейн (1942) установил, что у морских свинок при «подъеме» в барокамере на высоту 9500 м на 30 мин наблюдалось снижение веса и концентрации аскорбиновой кислоты в крови. Развивались симптомы С-гиповитаминоза. Аналогичные результаты получены исследованиями Г. А. Арутюнова и Н. С. Ярусовой (1947), А. Н. Климова (1956), Ashan G. (1953), Терperman Y. et al. (1947).
В условиях пониженного парциального давления кислорода А. Н. Климов (1956) наблюдал своеобразное перераспределение аскорбиновой кислоты между органами и тканями. Содержание ее в одних органах снижалось (надпочечники, почки, сердечная мышца), а в других (мозг, печень) увеличивалось. Перераспределение аскорбиновой кислоты в организме при воздействии разреженного воздуха в ряде случаев сопровождалось также увеличением уровня аскорбиновой кислоты в крови и торможением выведения ее с мочой. Введением аскорбиновой кислоты, предшествующим многократным воздействиям разреженного воздуха, автору удалось предотвратить снижение ее содержания в отдельных органах, в частности в надпочечниках, и обеспечить более высокое ее содержание в тканях печени и мозга. По утверждению автора, в условиях разреженного воздуха величины, характеризующие содержание в тканях аскорбиновой кислоты, сдвинуты в сторону увеличения и для насыщения организма требуются большие количества аскорбиновой кислоты. Во время тяжелых и утомительных горных переходов наиболее характерным оказалось увеличение выведения аскорбиновой кислоты с мочой и нарастание в ней количества окисленных продуктов (дегидроаскорбиновой и дикетогулоновой кислот). Автор это объясняет повышением скорости окисления аскорбиновой кислоты в организме в этих условиях.
Для предотвращения снижения содержания аскорбиновой кислоты в отдельных органах и организме в целом в условиях пребывания в разреженной атмосфере, при высотных полетах и тяжелых горных переходах суточная доза аскорбиновой кислоты для человека, по расчетам А. Н. Климова (1956), должна быть увеличена до 100 мг. И, наконец, автор, сопоставляя собственные наблюдения и литературные данные, заключает, что однократные приемы даже больших доз аскорбиновой кислоты не повышают выносливость организма к тем или иным воздействиям внешней среды, тогда как систематические приемы при длительном воздействии тех же факторов ускоряют акклиматизацию организма и таким путем повышают его выносливость. Полагают, что увеличение содержания аскорбиновой кислоты в организме в этих условиях является одним из показателей тех биохимических изменений, которые происходят в результате акклиматизации.
Исследованиями Н. А. Гаджиева (1958), Т. В. Микаберидзе (1969), М. К. Эсенамановой (1972) установлено, что у вновь прибывших в условия высокогорья людей наблюдается уменьшение содержания аскорбата в крови и моче.
В. А. Никонова и др. (1966) в опытах на крысах отметили, что подкожное введение аскорбиновой кислоты по 15 мг на 1 кг веса животных предотвращало снижение гликогена, нормализовало фосфорилазную активность скелетной мышцы, предотвращало нарушения проницаемости сосудов тканей в условиях барокамерной гипоксии, соответствующей высоте 8000 м.
Работами этих и ряда других исследователей установлено благоприятное влияние витамина С на обменные процессы в тканях в условиях гипоксической гипоксии.
В условиях кислородной недостаточности часто наблюдается снижение содержания окисленных форм пиридиновых коферментов и одновременное увеличение восстановленных их форм (Никонова В. А. с соавторами, 1966; Юрков Ю. А., Сафронова Т. Я., 1976), что отрицательно сказывается на уровне окислительных процессов. Внутримышечные введения крысам в течение 7 дней по 25 мг аскорбиновой кислоты в опытах М. М. Эпштейна с соавторами (1967, 1968, 1970) способствовали увеличению количества окислительных коферментов в сердечной и скелетной мышцах и в тканях печени.
Ими же установлено, что в условиях барокамерной гипоксии, соответствующей высоте 8000 м, интенсивность фосфорилирования в митохондриях головного мозга снижается на 32%, уменьшается в них также потребление кислорода на 20%. Предварительное введение аскорбиновой кислоты крысам (25 мг на 1 кг массы тела) приводило в опытах авторов к увеличению поглощения кислорода на 27% и связывания неорганического фосфора на 20% по сравнению с гипоксическими животными, не получавшими аскорбиновой кислоты. Таким образом, введение аскорбиновой кислоты способствует нормализации обменных процессов в тканях.
Вышеприведенные факты указывают, что витамин С имеет исключительно важное значение в приспособлении организма к условиям гипоксии. Однако вопросы изменения обеспеченности организма этим витамином, потребности в нем и его обмена в условиях гипоксической и особенно при высокогорной гипоксии изучены недостаточно.
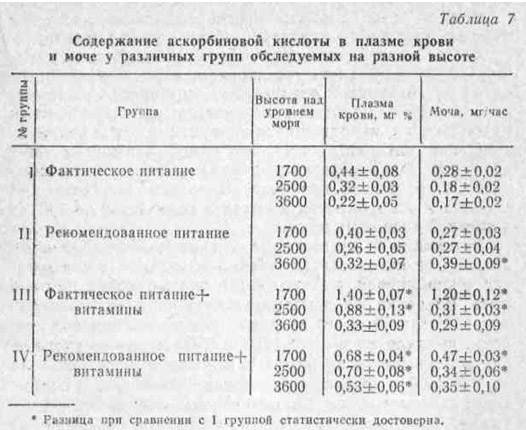
В наших исследованиях, проведенных ранней весной, было установлено, что уже подъем на высоту 1700 м приводит к заметному падению без того сниженной в связи с неблагоприятным периодом года концентрации аскорбиновой кислоты в плазме крови и моче (рис. 6). Это снижение особенно интенсивно происходит в первые недели пребывания людей на высоте.
По мере адаптации к указанной высоте наступала некоторая нормализация этих показателей. Так, у тех же наблюдаемых уже через месяц в крови и моче содержание данного витамина почти достигло исходных величин.
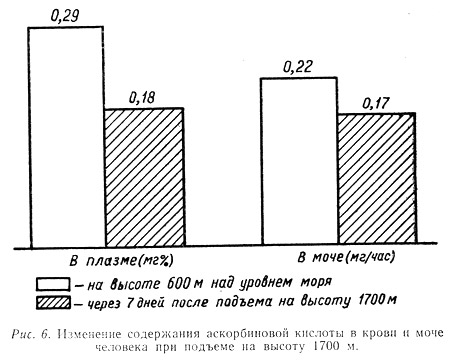
Это, по-видимому, объясняется тем, что в период активной адаптации, т. е. первые две-три недели пребывания на высоте, идет усиленное расходование аскорбиновой кислоты, связанное с процессами приспособления организма к этим субэкстремальным условиям внешней среды.
При сравнительно длительном наблюдении (в течение 2 — 3 лет) одних и тех же лиц, находившихся в одинаковых условиях питания, быта и трудовой деятельности, нам все же не удалось обнаружить полной нормализации уровня аскорбиновой кислоты в крови и моче. У них эти показатели не достигли нижней границы приводимых в литературе величин нормы (0,5 — 1,2 мг% и 0,7 — 1,0 мг/час).
Так, даже в сравнительно благоприятный сезон года — осенью — содержание аскорбиновой кислоты в плазме крови и моче у них соответствовало 0,44 мг% и 0,28 мг/час.
Низкому содержанию витамина С в крови и моче соответствовал ряд функциональных нарушений, косвенно характеризующих С-витаминную обеспеченность организма.
Так, установлено, что среди этих обследуемых повышение ломкости капилляров наблюдалось в 80% случаев. При капилляроскопическом исследовании лимба ногтевого ложа пальцев рук нередко обнаруживалась картина застоя и повышения проницаемости.
Работоспособность, выносливость, аппетит, сон, нейроэмоциональная сфера, основной обмен, функции анализаторов и другие характеристики общего состояния организма обследуемых на высоте 1700 м имели определенные сдвиги в сторону ухудшения по сравнению с аналогичными характеристиками наблюдаемых на равнине сверстников.
Анализ условий окружающей среды позволил установить, что у лиц, находившихся под нашим наблюдением, вышеуказанные признаки недостаточности витамина С могли быть обусловлены наряду с некоторым дефицитом этого нутриента в пище также и специфическим влиянием высокогорья. Об этом говорят следующие наши наблюдения.
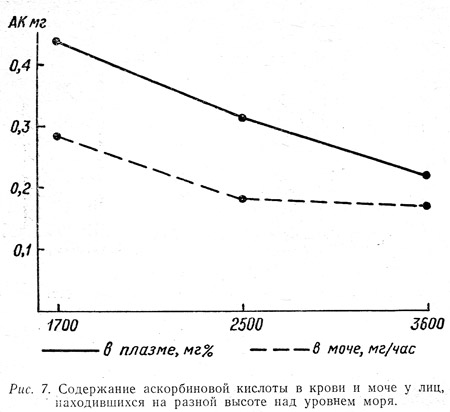
У разных групп людей, получавших ежедневно одинаковое питание и одинаковое количество витамина С и выполнявших одинаковую работу, но находившихся на разных высотах над уровнем моря (1700, 2500 и 3600 м), вышеуказанные показатели С-витаминной обеспеченности, исследованные в одно и то же время, существенно различались (рис. 7). Как видно из диаграммы, между уровнем содержания аскорбиновой кислоты в крови и моче и высотой над уровнем моря прослеживается почти обратная зависимость.
Эти результаты согласуются с данными ряда других исследователей (Гаджиев Н. А., 1958; Брагинский Б. М., 1963; Челнокова Н. А., 1966), указывающих на снижение витамина С в крови при гипоксии. Но наша задача, как известно, не была ограничена лишь исследованием С-витаминной обеспеченности на разной высоте, а охватывала более обширную проблему изучения питания вообще в этих условиях. Поэтому все вышеперечисленные показатели С-витаминной обеспеченности мы изучили на фоне различного характера общего фона питания.
Как было указано выше, учитывая недостаток фактического питания и аппетит наблюдаемых, а также исходя из литературных предпосылок, мы предложили так называемый рекомендованный рацион питания. Каждая из двух групп, находившихся на фактическом и рекомендованном питании, состояла в свою очередь из двух подгрупп. Одна подгруппа получала витаминный комплекс, а другая не получала. В состав поливитамина входила и аскорбиновая кислота в количестве по 100 мг в дневной дозе комплекса.
Как видно из данных табл. 7, сама по себе коррекция питания не внесла существенных изменений в содержание аскорбиновой кислоты как в плазме крови, так и в моче. Введение же дополнительного комплекса витаминов, в состав которого входило 100 мг аскорбиновой кислоты, вызвало на высоте 1700 и 2500 м резкое увеличение концентрации витамина С в крови и моче. Лишь на высоте 3600 м уровень содержания витамина С в плазме крови, несмотря на витаминизацию, не достиг даже нижней границы нормы, что, по-видимому, указывает на недостаточность дополнительной дозы аскорбиновой кислоты.
Однако на высоте 3600 м на фоне рекомендованного питания эта профилактическая доза аскорбиновой кислоты, т. е. 100 мг в день, оказалась достаточной для нормализации указанных показателей обеспеченности организма витамином С. В этой связи интересно отметить и то, что на высоте 1700 м более рационально, использовалась аскорбиновая кислота именно на фоне рекомендованного питания. Если на фоне фактического питания резкий подъем концентрации аскорбиновой кислоты в плазме крови сопровождался одновременным бесполезным ее выведением, то у лиц, получавших сбалансированное питание и витамины, этого не наблюдалось.
Лучшая обеспеченность организма витамином С на фоне рекомендованного питания, вероятно, связана прежде всего со сбалансированием белкового состава пищи. Такая закономерность на равнине нами была установлена в прежних исследованиях (Алдашев А. А., 1972; Шарманов Т. Ш., Алдашев А. А., 1978).
Кроме того, это улучшение обеспеченности витамином С, равно как и других показателей, несомненно, было связано с рационализацией соотношений и остальных компонентов пищи. В частности, рекомендованный рацион питания отличался от фактического также и повышенным содержанием легкоусвояемых углеводов, имеющих важное значение для питания в условиях гипоксии.
Более углубленные исследования по выявлению особенностей обмена витамина С в условиях высокогорья и при различном характере питания нами были проведены на экспериментальных животных (крысах и морских свинках). Эксперимент проводился как в горах (3400 м), так и в условиях барокамерной гипоксии.
В связи с этим следует отметить, что результаты, полученные в этих разных условиях опыта, существенно отличались друг от друга. Это прежде всего связано с тем, что нельзя полностью отождествлять естественные условия, где на животных, помимо гипоксии, действует еще целый ряд других факторов, таких, как ультрафиолетовые лучи, холод, ветер и т. д., и барокамеру, где животные подвергаются только воздействию разреженного воздуха. Кроме того, степень разреженности воздуха в этих двух наших постановках опыта была неравнозначна — 3400 м в горах и «подъем» на «высоту» 7000 м в барокамере. Нельзя не учитывать и то, что в горах животные находились сравнительно долго и постоянно, в течение всего периода наблюдения, а условиям барокамеры подвергались прерывисто — по 2 часа в день. Нами были изучены отдельные показатели обмена веществ в органах и тканях организма, что, естественно, невозможно проводить на людях. С целью изучения обмена витамина С мы определяли в различных биосубстратах содержание общей, восстановленной аскорбиновой кислоты и ее окисленных форм — дегидроаскорбиновой (ДАК) и дикетогулоновой кислот (ДГК).
При этом нами было установлено, что как в горах, так и вследствие барокамерной гипоксии концентрация аскорбиновой кислоты в плазме крови как морских свинок, так и крыс понижается. Эти животные получали общепринятые диеты.
Другая же группа получала рацион, служивший в определенной степени моделью разработанного нами для людей рекомендованного питания. В этой второй группе падение концентрации аскорбиновой кислоты было сравнительно менее выраженным, чем в первой группе. Относительно большее содержание аскорбиновой кислоты в крови отмечено, естественно, и в тех группах, которые получали дополнительное количество, витаминов, в составе которых содержался витамин С.
В органах крыс барокамерная гипоксия привела к усиленному биосинтезу витамина С. Увеличение содержания витамина С в органах у крыс, получавших рекомендованный рацион, происходило в основном за счет увеличения количества восстановленной аскорбиновой кислоты. То есть, рекомендованная диета позволила крысам, синтезирующим витамин С, сохранить содержание его на нормальном уровне, несмотря на то, что организм находился в экстремальных условиях. Следует отметить, что прибавка веса в этой группе была также больше.
Такая же закономерность отмечена и в натурных опытах.
У морских свинок же как барокамерная гипоксия, так и подъем в горы, наоборот, обусловили некоторое понижение содержания витамина С в органах. Все сдвиги обмена витамина С у морских свинок, получавших рекомендованный рацион (особенно витаминизированный) были гораздо менее выраженными, чем у находившихся на обычной диете. Содержание ДАК и ДГК в тканях у них было значительно меньше.
Среди этих животных наблюдалась сравнительно большая выживаемость (80%), тогда как в группе, получавшей обычный рацион, выжило всего 26%.
Таким образом, отмечено, что рекомендованный рацион питания с углеводной ориентацией, в частности с несколько большим содержанием легкоусвояемых углеводов и с дополнительным включением в его состав витаминов, в опытах на животных с барокамерной гипоксией и у людей в условиях высокогорья способствовал улучшению процесса обмена аскорбиновой кислоты и показателей обеспеченности организма этим витамином.
Витамин Е. Изучая обеспеченность организма различными витаминами в условиях высокогорья, мы обратили внимание на резкое снижение при этом содержания токоферола в крови наблюдаемых людей. Дальнейшее изучение данного вопроса обусловило ряд других исследований, представляющих самостоятельный интерес. В частности, исходя из антиоксидантного действия витамина Е, были затронуты некоторые аспекты перекисного окисления липидов, стойкость эритроцитов и т. д.
Гемолитическая анемия, некроз печени, мышечная дистрофия, экссудативный диатез, энцефаломоляция, нарушения функции половых желез, атеросклеротические повреждения периферических сосудов и многие другие нарушения, возникающие при недостаточности витамина Е, по-видимому, имеют общую патогенетическую обусловленность.
По утверждению большинства исследователей, это связано с антиоксидантной ролью витамина Е.
Как известно, этот витамин проявляет довольно мощный тормозящий эффект в отношении перекисного окисления липидов. В частности, установлено, что токоферолы выполняют в живых тканях роль биологических антиоксидантов, инактивирующих свободные радикалы и тем самым препятствующих развитию нерегулируемых, неферментативных, цепных свободнорадикальных процессов перекисного окисления ненасыщенных тканевых липидов молекулярным кислородом. Ненасыщенные же липиды являются важнейшими компонентами клеточных и субклеточных мембран. Поэтому усиление их неконтролируемого окисления, естественно, повреждает структуру и нарушает функцию мембран клеток и субклеточных органелл.
Это разрушение и лежит в основе разнообразных проявлений Е-гиповитаминоза. Кроме того, были получены сведения об участии токоферола в передаче генетической информации, в процессах клеточного деления и старения, а также злокачественного роста, регулировании метаболизма лекарственных веществ. Известны факты, подтверждающие роль витамина Е в активности различных энзиматических реакций, в регуляции процессов энергообразования и белково-липоидных взаимоотношений и т. д.
В связи со сказанным, естественно, мы обратили особое внимание на факты изменения обеспеченности организма витамином Е в условиях высокогорья. Последние, как известно, являясь не обычными, а порою экстремальными для нетренированного организма, обусловливают существенные перестройки во всех вышеупомянутых функциях организма. Быть может, именно нарушением обмена витамина Е во многом объясняются проявляемые в условиях высокогорья патологические симптомы. При этом, исходя из многогранного участия токоферола в сложных белково-липоидных, углеводных и других видах обмена веществ, естественно было допустить зависимость обеспеченности им от сбалансированности рациона питания другими нутриентами (белками, жирами, углеводами и пр.).
Сведения, указывающие на изменения обеспеченности организма витамином Е в условиях высокогорья, мы находим в наблюдениях, имевших место еще задолго до открытия этого нутриента.
Так, известно, что испанские конкистадоры, завоевавшие в XVI веке Перу, тяжело поплатились за свою агрессию. Установлено, что первый испанец родился спустя 53 года после переселения их в столицу Перу Потоси, расположенную в Андах на высоте 3900 м. В то же время рождаемость местного индейского населения оставалась нормальной. Отсутствие деторождаемости привело к тому, что испанские завоеватели вынуждены были перевести столицу Перу в Лиму, находившуюся на уровне моря.
Причину этого загадочного явления в настоящее время объясняют дефицитом витамина Е, который обнаруживается в условиях высокогорья у впервые прибывших в горы людей.
Таким образом, имеются прямые или косвенные указания на изменение обеспеченности организма витамином Е в условиях высокогорья.
Однако механизм этого явления совершенно не изучен. В этой связи представляют определенный интерес исследования Г. И. Цимермана и др. (1978), которые показали, что при острой гипоксии резко уменьшается отделение желчи, а концентрация в ней желчных кислот снижается. Как известно, нарушение желчеотделения, непременно приводит к подавлению всасывания жира и витамина Е. Последнее же, в свою очередь, обусловливает усиление перекисного окисления липидов. В работе Н. К. Шилиной и др. (1972) показано, что в условиях экспериментальной острой гипоксии наблюдается увеличение в организме продуктов перекисного окисления липидов — конъюгированных диенов. Л. М. Шафран и др. (1979) также отмечают накопление перекисей липидов в тканях при гипобарической гипоксии.
Таким образом, в литературе имеются единичные указания на изменение всасывания витамина Е и усиленный его расход в условиях экспериментальной гипоксии.
В наших исследованиях содержание витамина Е в крови, на высоте уменьшалось. Так, если на равнине в сыворотке крови токоферол у здоровых молодых мужчин в среднем содержался до 1,0 мг%, то у прибывших на высоту 1700 м при исследовании через 6 — 8 месяцев отмечено снижение его до 0,77 мг%. Если исходить из данных литературы, то это почти соответствует нижней границе нормы, принятой за 0,8 — 1,2 мг% (Абраров А. А. и др., 1974; Печуконене М. В., 1974; Chow С. К., 1975; Witting L., 1975). При подъеме этих же лиц на высоту 2500 м, уже через 2 — 3 недели пребывания отмечена дальнейшая тенденция к уменьшению (0,7 мг%). Восстановление же до исходных величин при возвращении на высоту 1700 м происходило сравнительно долго — в течение 1 — 2 месяцев. В первые дни возвращения даже отмечена тенденция к дальнейшему снижению, как бы напоминающему о последствиях высоты.
Дальнейшие наши наблюдения показывают, что уровень токоферола в крови, а также результаты ряда других исследований, в определенной степени позволяющие судить об обеспеченности организма витамином Е в условиях высокогорья, в значительной мере зависят от характера питания наблюдаемых.
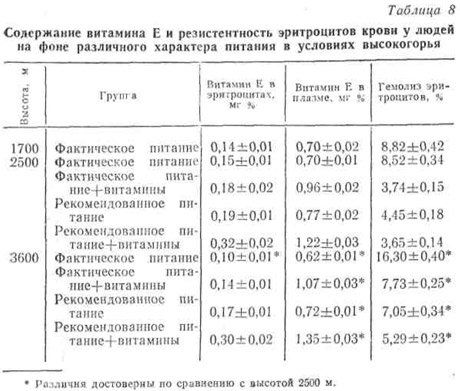
В частности, эти величины сильно варьировали в зависимости не только от обеспеченности витаминами, но и от общего фона питания. Как было указано выше, в рекомендованном нами питании в отличие от фактического было более рациональное соотношение как между белками, жирами и углеводами, так и между растительными и животными продуктами (глава III). Сочетание такого рекомендованного питания и витаминов даже на высоте 2500 м над уровнем моря привело к значительному увеличению содержания α-токоферола в эритроцитах и плазме крови. Эти показатели остались прежними и после подъема на высоту 3600 м. Аналогичные изменения претерпевала и стабильность эритроцитарной мембраны, о которой судили по проценту гемолиза эритроцитов (табл. 9).
В первые дни подъема на высоту отмечено некоторое увеличение содержания токоферола в крови наблюдаемых во всех группах, что, вероятно, связано с выбросом его из депо в ответ на изменившиеся условия окружающей среды. Но при повторном исследовании через 10 — 12 дней в контрольной группе (I группа), находившейся на фактическом питании, оно уменьшилось до 0,62 мг% на высоте 3600 м. Это, по утверждению Шмандке (1975), близко к Е-гиповитаминозу. Соответственно отмечен и самый высокий процент гемолиза эритроцитов.
Хотя дополнительная витаминизация привела к повышению концентрации α-токоферола в плазме и на фактическом фоне питания, однако по сравнению с таковой у получавших рекомендованный рацион наблюдалось заметное снижение этого показателя в эритроцитах и падение резистентности последних.
В данном случае витаминосберегающий эффект рекомендованного питания, по-видимому, больше всего связан с рационализацией его жирового состава. В частности, это, вероятно, связано с избытком получаемых с фактическим питанием растительных жиров, в которых, известно, имеется большое число ненасыщенности как, в процессе метаболических перестроек вовлекающей витамин Е, с чем, может быть, и связана его усиленная утилизация (Gloind Е., 1973; Horn L. R. et al., 1974). Кроме того, качественная белковая неполноценность фактического питания из-за аминокислотного дисбаланса, по-видимому, обусловливает нарушения синтеза ферментов глутатионпероксидазной системы и их субстратов, в частности восстановленного глутатиона. Это приводит к нарушению функционирования системы Е-глутатионпероксидазы и, как следствие, нарушению функционирования мембран эритроцитов.
Все сказанное согласуется с данными, полученными при исследовании содержания перекисей и активности глутатионредуктазы в плазме и эритроцитах крови наблюдаемых групп.
Как видим, имеется определенная закономерность между содержанием малонового диальдегида (МДА) в плазме и эритроцитах крови при 1,5 — 2-кратном увеличении скорости перекисного окисления ПНЖК мембран-эритроцитов после восхождения на высоту 3600 м и активностью фермента глутатионредуктазы, ответственното за поставку восстановленного глутатиона для глутатионпероксидазы.
В контрольной (I) группе уровень малонового диальдегида в плазме крови и эритроцитах после подъема на высоту 3600 м значительно увеличился. Активность же глутатионредуктазы в крови при этом заметно снизилась.
Наименьшие изменения в содержании МДА при двукратном ускорении его образования в эритроцитах после восхождения наблюдались нами в группе, получавшей рекомендованное питание с дополнительным количеством витаминов. Отмечена также высокая активность глутатионредуктазы в этой группе. Причем в гемолизатах эритроцитов она даже увеличилась. На высоте 3600 м в группах, получавших рекомендованное питание и фактическое питание с витаминами, хотя и произошло увеличение уровня МДА в плазме, но его содержание достигло лишь величин, зафиксированных нами в контроле на высоте 2500 м. Однако в эритроцитах, где скорость образования МДА была несколько ниже, чем в группе, получавшей рекомендованное питание плюс витамины, выявлено полуторакратное увеличение его содержания. Это хорошо согласуется с падением глутатионредуктазы в гемолизатах эритроцитов. Следует отметить, что содержание МДА в плазме и эритроцитах на высоте 2500 и 3600 м находилось в определенной зависимости от активности фермента глутатионредуктазы. А, как известно, при недостаточной концентрации восстановленного глутатиона возникает гемолитическая анемия (Симановский Л. Н., 1971), нарушается процесс оксигенации и образуется метгемоглобин вследствие инактивации тиоловых систем эритроцитов под влиянием агентов, окисляющих Н-группы (Соколовский В. В., Павлова Л. М., 1960; Кочеткова М. К. и др., 1966). К таковым мы можем отнести продукты свободнорадикального окисления липидов (Владимиров Ю. А., Арчаков А. П., 1972).
Таким образом, полученные данные указывают, что при подъеме на высоту 3600 м увеличивается потребность организма в витамине Е в связи с ускоренным образованием перекисей. Однако только в группе, содержавшейся на рекомендованном рационе питания и получавшей витамины, двукратное ускорение образования МДА не привело к его накоплению в плазме и эритроцитах за счет сохранения активности глутатионредуктазы на первоначальном уровне, что свидетельствует о достаточной обеспеченности организма витамином Е.
Никотиновая кислота. Общепризнана роль коферментных систем в повышении устойчивости организма при недостаточности кислорода и физических нагрузках, так как именно они связывают воедино наибольшее число метаболических реакций, определяя специфику и интенсивность как тканевого дыхания, так, по сути дела, и всех других процессов жизнедеятельности.
С этой точки зрения важная роль тиамина, рибофлавина, никотиновой кислоты и ряда других витаминов, входящих в состав таких коферментных систем, очевидна.
Одним из коферментов, универсальных по распространению и биологической роли, является никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ). Они служат простетической группой большого количества оксиредуктаз, которые принимают участие в дегидрировании субстратов и в переносе электронов в дыхательной цепи митохондрии. Исходя из огромной роли НАД и НАДФ в окислительных процессах, можно твердо предполагать, что содержанием и состоянием этих коферментов может определяться ряд особенностей метаболизма, особенно энергетического обмена при гипоксии.
По литературным данным, при гипоксии и длительной физической нагрузке происходят интенсивное расщепление и деградация пиридиннуклеотидов (Северин С. Е., Цейтлин Л. А., 1966; Федорова Г. П., 1966), что может усугубить кислородное голодание.
Между тем известно, что обогащение организма никотинамидными коферментами лучше способствует адаптации организма при недостаточности кислорода. Так, по данным М. С. Рейзина (1965), при дополнительном введении никотинамида устойчивость животных к гипоксии увеличивается. П. И. Лукиенко (1971) констатирует, что НАД и НАДФ при подкожном введении повышают устойчивость мышей и крыс к острой гипоксии и улучшают утилизацию кислорода скелетными мышцами. М. М. Эпштейн и др. (1968) пришли к выводу, что накоплению пиридиновых коферментов, окисленных и восстановленных форм с преобладанием окисленных в условиях гипоксии способствовало предварительное введение никотиновой кислоты.
В наших наблюдениях подъем людей в горы сопровождался некоторым снижением содержания витамина РР в крови. Рекомендованное питание с преобладанием легкоусвояемых углеводов со сбалансированным аминокислотным и витаминным составом привело к нормализации этого показателя. В эксперименте на животных барокамерная гипоксия, соответствующая высоте 7000 м, сопровождалась уменьшением никотиновой кислоты в головном мозге и сердце.
Рекомендованный рацион несколько сглаживал эти сдвиги.
Витамин Р. Исходя из роли витамина Р в повышении активности окислительно-восстановительных ферментов, следует допустить мысль о его пользе при гипоксии и, следовательно, в условиях высокогорья. Тем более, что в литературе имеются единичные указания на вероятность такого предположения. Так, в опытах Ф. П. Космолинского (1961) на «высоте» 10 000 м в барокамере состояние крыс, получавших предварительно витамин Р, было лучше, чем у контрольных.
Автор объясняет это явление прежде всего активацией дыхательных ферментов под влиянием биофлавоноидов.
Так, автор установил, что у контрольных животных при «подъеме» на «высоту» активность цитохромоксидазы и дегидраз резко падала, тогда как у опытных крыс это снижение было гораздо менее выраженным.
Но, вероятно, не только этим обусловлен эффект данного витамина. Как известно, последний является мощным средством, улучшающим состояние капилляров, нарушение функции которых в условиях кислородного голодания является установленным фактом.

